Les écoutes en altitude des chauves-souris
- Accueil
- Les écoutes en altitude des chauves-souris
Méthodes et suivis BIOACOUSTIQUES DES CHAUVES-SOURIS
Grâce aux ultrasons émis par les chauves-souris, il est possible de les détecter et d’enregistrer les ultrasons à l’aide d’enregistreurs acoustiques. Ces enregistreurs qui fonctionnent en autonomie, comme des pièges photographiques, se déclenchent automatiquement au passage des ultrasons et enregistrent les sons sur des cartes mémoires ou des disques durs. Cependant il peut y avoir autant de spécificités et de choix technologiques pour déclencher automatiquement un enregistrement que de fabricants et d’appareils disponibles. Par ailleurs, les gammes de fréquences ultrasonores utilisées par les chauves-souris sont variables d’une espèce à l’autre, entre 9 kHz et 150 kHz, ce qui implique des différences notables de détectabilité.
En amont d’un projet de parc éolien et/ou pour les suivis de parcs en exploitation, ces enregistreurs sont placés sur des mâts de mesures ou dans les éoliennes pendant la saison d’activité des chauves-souris de mars à novembre.
Un ou plusieurs micros ?
Lorsqu’un enregistreur est placé dans une éolienne, il est conditionné dans une armoire électrique IP66 à l’intérieur de l’éolienne. L’armoire électrique peut -être située tout en bas, sur le palier intermédiaire, ou tout en haut dans la nacelle (dans 80% des cas). Un microphone est placé à l’extérieur de la nacelle, ce qui permet une écoute optimale des chauves-souris en altitude. Mais là encore selon les modèles d’éoliennes et les constructeurs, plusieurs choix sont possibles entre le plancher, la façade supérieure ou arrière d’une nacelle, ce qui n’engendre pas du tout les mêmes volumes de détectabilité.
Lorsqu’un enregistreur est placé sur un mât de mesures, généralement utilisé avant la construction d’un parc, il est aussi conditionné dans une armoire électrique mais alimenté avec des panneaux solaires. En général, dans cette configuration nous utilisons un enregistreur à deux pistes ce qui permet de brancher deux micros synchronisés, qui sont placés à deux hauteurs différentes. La hauteur de chaque micro est calculée pour correspondre aux objectifs de l’étude, portant sur l’analyse des risques liés à la zone de rotation des pales des futures éoliennes. On peut ainsi aisément obtenir la part de l’activité enregistrée au-dessus et en dessous de la hauteur médiane entre les deux micros.
En utilisant un seul micro placé sur la hauteur maximale, on prend le risque de surestimer l’activité en hauteur, puisqu’il est impossible de préciser pour une espèce à portée sonar supérieure à 30-40 mètres, si elle est passée à moins de 30 mètres du sol ou à plus de 80 mètres. En effet, un micro peut capter aussi bien ce qui se passe en dessous qu’au-dessus. L’usage de deux micros permet alors d’éliminer les doubles comptages et d’être plus près de la réalité en ce qui concerne l’activité en hauteur sur laquelle on se base pour estimer les risques de collision.

A gauche : l’armoire électrique avec le SM3 bat en haut et SM4BAT en bas
A droite : l’armoire électrique sur mât de mesure avec panneaux solaires
La diversité des sonars et de la biologie des espèces : variabilité de la détection
En France, il existe 35 espèces de chauves-souris qui émettent des ultrasons à différentes fréquences, avec des modulations dans la structure et l’intensité des signaux. Ces modulations sont liées à la biologie de l’espèce mais aussi au type de milieu et à la présence de proies. Plus un milieu est encombré (ex. une forêt) ou plus il y a de proies (ex. papillons de nuit), plus la chauve-souris va émettre des ultrasons à fréquences rapprochées et abruptes, ce qui lui permettra d’éviter des obstacles ou d’attraper ses proies. A l’inverse, en migration et à haute altitude (milieu ouvert), la chauve-souris va émettre des signaux plus espacés dans le temps et moins modulés en fréquences (FM dites « aplanies »). Selon les circonstances et les espèces, l’intensité des émissions en dB pourra aussi varier.
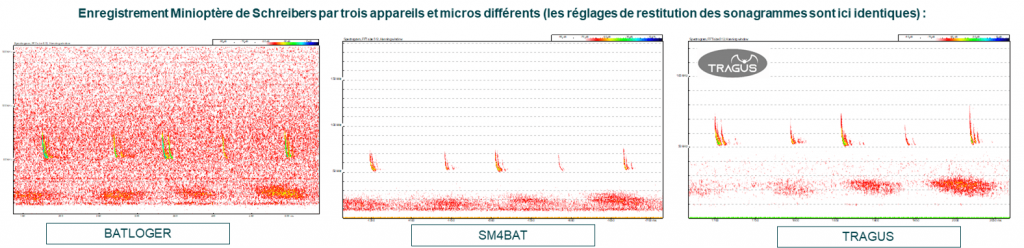
La modulation biologique de ces sons engendre des variabilités de détection par les enregistreurs acoustiques qui, selon leurs caractéristiques de micro, de réglages, etc., ne produiront pas tous la même quantité de fichiers enregistrés, avec des écarts parfois très importants.
Par exemple, en France, les deux plus grandes espèces de chauves-souris que sont la Grande Noctule et le Molosse de Cestoni émettent des émissions de très basses fréquences (entre 9 et 13 kHz), qui ne seront pas ou très mal détectées par un Batcorder. Le Batcorder a pour défaut de filtrer sévèrement les fréquences basses afin d’éviter un maximum de bruits parasites. Il est donc susceptible de se déclencher à partir de 14-16 kHz, à l’inverse des autres enregistreurs qui peuvent se déclencher à partir de 1 kHz.
Inversement, certaines espèces utilisent de très hautes fréquences comme les rhinolophes ou encore certains murins comme le Murin à oreilles échancrées. L’usage d’un enregistreur dont le taux d’échantillonnage fréquentiel est trop réduit (par exemple 192 kHz) ou de micros peu sensibles sur les hautes fréquences ou défaillants, peut engendrer un sévère défaut de détectabilité de ces espèces.
Le choix du modèle de l’enregistreur et des réglages sont donc primordiaux. Il varie principalement en fonction du niveau de détection recherchée, des espèces ciblées, et de l’environnement de la zone d’étude. Pour remédier à ces paramètres de variabilité, il est primordial que le chiroptérologue (l’expert en chauves-souris) connaisse parfaitement la biologie, l’écologie, le comportement des différentes espèces de chauves-souris et les capacités techniques du matériel utilisé.
Deux ouvrages de référence, édités par les Editions Biotope, avec Michel BARATAUD, Laurent ARTHUR et Michèle LEMAIRE ont pour objectif d’approfondir les connaissances à ce sujet : Les Chauves-souris de France, Belgique, Luxembourg et Suisse et Ecologie acoustique des chiroptères d’Europe.
La diversité des microphones et des câbles : source de différences de détectabilité
Pour chaque enregistreur il existe différents types de microphones. La forme du micro, sa matière et la capsule utilisée vont faire varier le niveau de détection du fait de la directivité, la sensibilité aux différentes fréquences, le type d’amplification ou de réglage de gain, et la durabilité du microphone. Certains microphones sont équipés d’un système d’amplification et/ou d’un convertisseur analogique pour une meilleure transmission des sons à l’enregistreur. Certains peuvent être raccordés avec des câbles de plus de 100 mètres de long, ce qui en analogique est déjà une prouesse en matière d’ultrasons. La qualité du câble et des connecteurs sont également importants dans la transmission du son afin d’éviter des pertes de signaux et des bruits parasites.
Si les signaux sont tous bien restitués et identifiables, la qualité et l’intensité du bruit de fond, la présence ou non de parasites n’est pas la même, tout comme la sensibilité aux différentes fréquences, notamment ici les basses, moyennes et hautes fréquences.
La diversité des solutions techniques et des réglages : source de différences de résultats
Plusieurs études dont la plus célèbre et pionnière a été celle de Adams et al. (2012 – Do you hear what I hear? Implications of detector selection for acoustic monitoring of bats) comme la plupart des gros utilisateurs ont montré que les divers modèles d’enregistreur pouvaient se comporter assez diversement et donner une quantité de fichiers assez variables pour un même nombre d’évènements de chiroptères.
Cela n’est pas surprenant quand on sait que ce qui est compté et assimilé à une activité exprimée en nombre de contacts par unité de temps, sont en réalité les fichiers enregistrés.
Or la chaine des conditions pour qu’un appareil délivre suite à un passage de chauve-souris, un fichier contenant l’enregistrement des signaux de l’animal, est assez variable d’un appareil à l’autre et dépend aussi d’un certain nombre de réglages qui devraient être standardisés.
Outre les biais liés aux micros et au câblage les reliant à l’enregistreur, pour éviter que les appareils n’enregistrent en continu, tous incorporent ce qu’on appelle un « trigger » qui sert à « décider » en fonction de divers paramètres logiciels, de déclencher ou non un enregistrement qui sera stocké sur carte mémoire ou disque dur. Le mode de fonctionnement des triggers est souvent différent d’un type d’appareil à l’autre et dépend des choix des fabricants en la matière :
- On peut par exemple régler un seuil d’intensité sonore en dB à partir duquel si celui-ci est dépassé, l’appareil déclenche un enregistrement. Ce seuil peut être mesuré en valeur absolue ou relative par rapport au bruit ambiant.
- La fenêtre de durée pendant laquelle le trigger est en alerte peut aussi se régler et varier. La durée minimale ou maximale du niveau d’intensité sonore d’un bruit qui dépasse ou pas le réglage du seuil de trigger peut aussi parfois être réglé.
- Les modes opératoires et les fonctions logicielles des différents réglages possibles sont également propres à chaque fabricant. On peut ainsi régler des seuils en dB sur un appareil et à l’aide d’une incrémentation de valeurs de 1 à 10 sur un autre.
Beaucoup de choses et de réglages sont ainsi possibles, mais aussi de façon de le faire, si bien qu’il est très difficile pour ne pas dire impossible de régler à l’identique deux appareils différents afin d’espérer qu’ils puissent se comporter de la même façon et donc de produire in fine plus ou moins le même nombre de fichiers. Les écarts de résultats constatés peuvent en fait être très importants. Adams et al. avaient essayé dans leur étude, après tout une série de tests, de proposer des grilles de réglage censées être similaires entre les divers appareils. Nous avons aussi pratiqué des tests en R&D qui ont véritablement montré aussi ce problème. C’est pourquoi nous recommandons toujours de bien choisir le matériel, ses réglages et les modes opératoires.
Figure: graphe et réglages proposés par Adams et al., 2012.
La diversité des logiciels pour traiter les fichiers : résultats plus ou moins fiables
Sur le marché, il existe plusieurs solutions logicielles pour trier et identifier automatiquement les sons collectés en masse. Il faut savoir qu’un enregistreur du type SM4BAT peut capter et enregistrer en moyenne 4Go de sons par nuit, c’est-à-dire plus de 1000 séquences. Il est alors très compliqué pour un chiroptérologue d’analyser et de vérifier un par un les sons manuellement.
Selon le type de logiciel utilisé, les résultats peuvent encore être très différents. Ils dépendent principalement de la qualité des enregistrements traités (donc dépendant du matériel et des conditions d’enregistrement), de la quantité d’évènements sonores d’une séquence (plusieurs individus et espèces peuvent être présents ce qui complexifie la tâche), de la qualité des bases de sons de référence dont l’origine géographique est très importante, et bien évidemment des algorithmes de détection des signaux, de mesure de ces derniers et finalement des traitements statistiques ou d’IA utilisés.
A ce jour, la plupart des associations et amateurs utilisent le système Tadarida, édité et proposé gratuitement par le Muséum. La plupart des bureaux d’études utilisent le logiciel SonoChiro édité et commercialisé par Biotope. Un article sur les logiciels d’analyse des fichiers paraitra bientôt sur notre site internet.
La diversité des méthodes pour interpréter et analyser les résultats sur un site : quelle évaluation, quel niveau de confiance ?
L’utilisation de différents matériels d’écoute en France et des divers biais possibles exprimés auparavant est une véritable problématique pour comparer l’activité chauve-souris d’un site d’étude à un autre.
Un test comparatif SMXBAT et BATCORDER a été réalisé par un ancien salarié de Biotope, Charlotte ROEMER, sur un mât de mesures dans le sud de la France. Cette expérience démontre très clairement que le choix de l’enregistreur est primordial. On s’aperçoit que le BATCORDER est beaucoup moins sensible que le SMXBAT et n’a pas détecté le Molosse de Cestoni alors que cette grande espèce dite de haut vol, est concernée par les risques de collision. Pour cette dernière raison et par rapport à la répartition du Molosse de Cestoni, de la Grande Noctule, mais plus globalement des cris sociaux des pipistrelles et noctules sur l’ensemble du territoire national, il n’est pas concevable d’utiliser un BATCORDER dans une bonne moitié de la France.
Alors vous êtes plus « 5 secondes » ou plus « Minute positive » ?
Pour mesurer l’activité et la richesse d’un milieu en chauves-souris, la très grande majorité des chiroptérologues comptent le nombre de contacts chauves-souris sur une période maximale de 5 secondes. Il s’agit de la méthode Barataud.
Or, M. Barataud a proposé et défini cette méthode de comptage uniquement dans le cadre des expertises dites « manuelles », c’est-à-dire avec un observateur qui manipule un détecteur à main lors de courts points d’écoutes ou de transects (30 minutes à quelques heures), et qui fait lui-même le « trigger », en comptabilisant les contacts sur la base de 1 contact = une séquence durant maximum 5 secondes.
Lorsque l’on travaille en méthode « passive » avec des enregistreurs automatiques, et que l’on souhaite appliquer ce type de comptage, cela revient à diviser le nombre de fichiers (= contacts) obtenus par la durée de la nuit pour passer en contacts / heure (moyenne sur la nuit). Cette façon de faire est donc assez différente de la méthode d’origine, et introduit des biais d’interprétation et d’analyse importants car on considère alors que le détecteur déclenche et donc « compte » de façon identique à ce que ferait un observateur actif, ce qui évidemment est loin d’être équivalent.
En effet, pour transposer la méthode manuelle « Barataud », il faut programmer les enregistreurs avec une durée de fichier maximale de 5 secondes, espérant que le trigger (automatique) produira le même nombre de fichiers que le nombre de contacts comptés par un observateur actif. Or, comme vu précédemment, les Triggers se comportent assez différemment d’un d’appareil à un autre, et la réactivité de réarmement (la capacité de relancer un fichier une fois un enregistrement lancé et terminé) est aussi différente, pouvant aller jusqu’à une seconde !
En conséquence, un Batlogger A+ par exemple est très sensible et a des fenêtres temporelles assez courtes, durant lesquelles il continue à enregistrer tant que des bruits qui ont dépassé le seuil de trigger sont présents. Cela produit finalement des fichiers qui sont en moyenne de plus courte durée que ceux d’un SM4BAT, qui lui, ne coupera pas facilement un fichier tant qu’il y a du bruit trigger déclenchant, avant d’atteindre la taille maximale de 5 secondes. Pour qu’un SMBAT produise des fichiers plus courts, il faut pratiquement une absence de bruit durant 2-3 secondes (durée programmable).
Ainsi, par exemple, pour 10 chiroptères qui passent durant une minute, et considérant que les appareils ont bien déclenché sur ces 10 chiroptères, on n’obtiendra pas le même nombre de fichiers (enregistrements) selon l’appareil utilisé. La raison : le Batlogger aura fait par exemple 15 fichiers de 3 secondes, le SM4BAT peut-être 10 fichiers de 4-5 secondes ; et un autre appareil qui fournirait toujours la même durée de fichier programmable, soit par exemple 5 secondes, 9 fichiers pour 10 chiroptères passés.
Si nous considérons une nuit complète, des écarts significatifs sont obtenus selon l’appareil utilisé, alors que tous sont programmés en 1 contact = maximum 5 secondes.
Généralement, les enregistreurs auront tous tendance à sous-estimer le nombre de passages, sans compter les temps morts de réarmement des triggers, par rapport à un comptage en direct de l’observateur. Ainsi, on ne peut absolument pas donner des résultats d’enregistreurs automatiques en contacts = fichiers, comme s’il s’agissait d’enregistrements manuels, et encore moins comparer avec des résultats obtenus en détection directe.
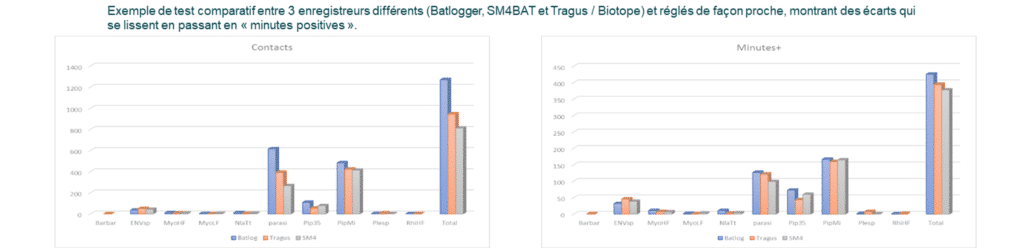
Ainsi, pour compenser tous les biais possibles et la variabilité des différents enregistreurs, il est souhaitable de comptabiliser non pas le nombre de contacts réels, mais la présence ou l’absence de contacts (= fichier) sur une période maximale de 60 secondes. Il s’agit de la méthode dite « minutes positives ».
Dans le cadre d’enregistrements automatiques, des auteurs scientifiquement reconnus ont déjà utilisé le concept de la « minute positive », notamment les américains par Miller (2001). Biotope avec les travaux d’Alexandre Haquart a suivi cette démarche en publiant un diplôme EPHE, validé en 2013, sur la base de la « minute positive », qui permet de pallier aux problèmes d’écart de détectabilité constatés entre appareils, même si ces derniers sont de modèle identique.
Les tests statistiques ont montré que les variations liées au matériel étaient moins fortes avec cette unité de dénombrement (qu’il y ait un contact ou 10 dans une minute, l’incrémentation correspondra à 1). Elle évite des écarts de 1 à 10 en cas de forte activité. Et en cas de faible activité, les résultats de dénombrement de minutes positives ou de fichiers d’enregistrements (correspondant à l’unité de contact) sont sensiblement les mêmes.
La principale critique à la « minute positive » est due au fait qu’elle lisse légèrement les pics d’activités (mieux détectés par la méthode manuelle), mais en contrepartie elle lisse également des variations de détectabilité acoustique des espèces liées aux conditions climatiques locales et à l’utilisation de matériels et de paramétrages hétérogènes. C’est donc un compromis qui permet de s’adapter à la diversité des contextes d’expertises.
Notons aussi que les écarts de mesure d’activité entre « contacts de 5 secondes » et « minutes positives » ne sont pas significativement différents sur des nuits complètes.
Cette approche comptable de l’activité des chiroptères par la « minute positive » permet également d’utiliser un maximum de points de référence en palliant les disparités de matériels et de conditions, afin de comparer des résultats obtenus à une base de données de référence.
Biotope a ainsi utilisé toutes ses études des diverses régions de France pour produire le référentiel Actichiro®.qui porte aujourd’hui sur plus de 10 000 points d’écoute répartis en France, avec une déclinaison par région biogéographique et par classe de hauteur de mesure pour les études sur mât et éolienne. Il propose des chiffres objectifs qui permettent d’évaluer le niveau d’activité d’une espèce ou un groupe d’espèces sur un point ou un site donné. Ces chiffres de référence sont exprimés en minutes positives par nuit. Pour définir si l’activité est « Faible », « Moyenne », « Forte » ou « Très forte », l’analyste s’appuie sur les valeurs des quantiles à 25%, 75% et 98% qui servent de valeurs seuil entre les niveaux d’activité.
A ce jour, pour la France, les référentiels Actichiro et celui produit par l’équipe Vigie Chiro du MNHN sont les plus solides. Le référentiel Vigie chiro est toutefois toujours en cours d’implémentation basé sur des données très partielles sur certaines régions, et n’existe pas encore pour les études en hauteur.
En conclusion
Conscient de l’ensemble des problématiques liés aux techniques et au matériel utilisé pour les études sur les chiroptères et qui plus est pour des installations fixes sur de longues périodes dans un environnement hostile (mât de mesure ou éolienne), Biotope fort de l’expérience de ses chiroptérologues qui œuvrent partout en France et à l’étranger, de ses projets d’innovation (Chirotech, Actichiro, Sonochiro, Sonospot, Tragus…) et de sa filiale de vente de matériel et d’édition, recense les meilleures solutions pour répondre aux attentes de ses clients et des services instructeurs.
Bref historique : il y a des années en arrière au tout début de la bioacoustique, nous avons d’abord opté et été à l’initiative en France, des premières solutions d’enregistrement automatisées par division de fréquence avec les ANABAT de chez Titley. Nous avons ensuite été pionniers de l’usage massif des SM2BAT de wildlife acoustics, de l’essor des SM3BAT et SM4BAT, tout en développant et commercialisant un logiciel d’analyse (Sonochiro). En parallèle nous avons lancé des études scientifiques diverses pour améliorer la qualité des expertises (Actichiro et diplôme EPHE par A.Haquart, thèse suivie de 4 articles de Charlotte Roemer …), et proposé des solutions pour réduire les risques de collision (programme Chirotech). D’autres outils ont également été produits en interne pour répondre à nos propres besoins d’expertise et de suivis (Outils Shiny « suivis mortalité », outils Shiny d’analyse de l’activité, outils de trajectographie 3D…).
Tout en continuant nos tests sur des produits nouveaux sur le marché (BatmodeS et Balogger WE), que nous avons même parfois utilisé sur certains suivis, nous avons enfin depuis 3 ans développé notre propre solution TRAGUS : un enregistreur multipistes (x4) intelligent et connecté. Pour être tenu informé de la disponibilité de Tragus, inscrivez-vous ici.
L’objectif de TRAGUS est de fournir un nouveau matériel à prix contenu et répondant à des caractéristiques qui n’existent pas sur les produits actuels et dont nous avons tous besoin aujourd’hui, notamment l’accessibilité sur une large couverture géographique (y compris en pleine mer), une très faible sensibilité aux parasitages électromagnétiques, la sécurité de la donnée, une stabilité électrique en cas de coupure…
Avec cet article, la bioacoustique des chauves-souris et les chiroptérologues de Biotope vous livrent quelques-uns de leurs secrets techniques et scientifiques. D’autres communications sur le monde de l’éolien sont à venir, si vous souhaitez être informé, inscrivez-vous ci-dessous.
Pour continuer à être informé, inscrivez-vous ici.